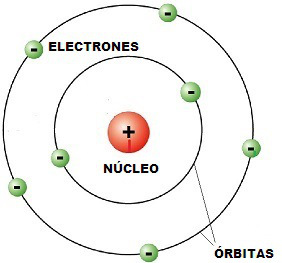
Protones: es una partícula subatómica con una carga eléctrica elemental positiva 1 (1,6 × 10-19 C), igual en valor absoluto y de signo contrario a la del electrón, y una masa 1836 veces superior a la de un electrón.
Neutrones: es una partícula subatómica, un nucleón, sin carga neta, presente en el núcleo atómico de prácticamente todos los átomos, excepto el protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres partículas fundamentales cargadas llamadas quarks, cuyas cargas sumadas son cero. Por tanto, el neutrón es un barión neutro compuesto por dos quarks de tipo abajo, y un quark de tipo arriba.
Subíndices: en tipografía, es el número, letra, símbolo o indicador que aparece en tamaño más pequeño que la escritura normal y que se encuentra ligeramente por debajo (subíndice) o por encima (superíndice) de la línea de escritura normal (baseline). Los subíndices aparecen en o por debajo de la línea base, mientras que los superíndices aparecen por encima. Los subíndices y superíndices quizás más conocidos son los que aparecen en fórmulas matemáticas (índice (matemática)), expresiones y descripciones de compuestos químicos o isótopos, pero tienen también otros muchos usos.
Coeficiente: Es una forma esquemática y sencilla de expresar, mediante símbolos y fórmulas, los cambios ocurridos en el transcurso de una reacción.
Elemento: es un tipo de materia constituida por átomos de la misma clase. En su forma más simple posee un número determinado de protones en sunúcleo, haciéndolo pertenecer a una categoría única clasificada con el número atómico, aún cuando este pueda desplegar distintas masas atómicas.
Compuesto: es una sustancia formada por la combinación de dos o más elementos diferentes de la tabla periódica. Los compuestos son representados por una fórmula química. Por ejemplo, el agua (H2O) está constituida por dos átomos de hidrógeno y uno de oxígeno.
Número atómico: indica la cantidad de protones que se encuentra presente en el núcleo de un átomo.
Número de masa: es la suma del número de protones y el número de neutrones del núcleo de un átomo. Se simboliza con la letra A (el uso de esta letra proviene del alemán Atomgewicht, que quiere decir peso molecular, aunque sean conceptos distintos que no deben confundirse).
Ion: es una partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutro. Conceptualmente esto se puede entender como que, a partir de un estado neutro de un átomo o partícula, se han ganado o perdido electrones; este fenómeno se conoce como ionización.
Anión: es un ion (o ión) con carga eléctrica negativa, es decir, que ha ganado electrones.1 Los aniones monoatómicos se describen con un estado de oxidación negativo. Los aniones poliatómicos se describen como un conjunto de átomos unidos con una carga eléctrica global negativa, variando sus estados de oxidación individuales.
Catión: es un ión con carga eléctrica positiva, es decir, que ha perdido electrones. Los cationes se describen con un estado de oxidación positivo. En términos químicos, es cuando un átomo neutro pierde uno o más electrones de su dotación original, este fenómeno se conoce como ionización.
Diferencia entre cambio físico y químico:
Fisica:
No pierde sus propidades.
Quimica:
Se transforma en nuevas sustancias.

.jpg)