La estructura electrónica de un átomo describe las energías y la disposición de los electrones alrededor del átomo. Gran parte de lo que se conoce acerca de la estructura electrónica de los átomos se averiguó observando la interacción de la radiación electromagnética con la materia.
Sabemos que el espectro de un elemento químico es característico de éste y que del análisis espectroscópico de una muestra puede deducirse su composición.
El origen de los espectros era desconocido hasta que la teoría atómica asoció la emisión de radiación por parte de los átomos con el comportamiento de los electrones, en concreto con la distancia a la que éstos se encuentran del núcleo.
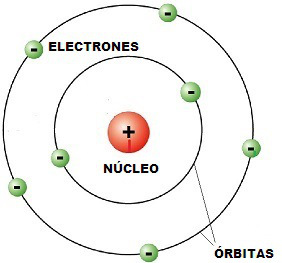
Estos ejemplos son los modelos de Bohr en números.
- Aluminio: é totales:13, p+ totales:13. #é valencia:2
- Hidrógeno: é totales:1, p+ totales:1, #é valencia:1
- Carbono: é totales:6, p+ totales:6, #é valencia:4
Lewis
El diagrama de Lewis nos sirve para representar los enlaces entre los elementos para su estabilidad.
Hay 3 tipos de enlaces covalentes:
- E.C Sencillo: Se comparte 1 par de é de valencia 2é
- E.C Doble: Se comparte 2 pares de é de valencias 4é
- E.C Triple: Se comparten 3 pares de é de valencias 6é

No hay comentarios:
Publicar un comentario